立项流程
机构办主任、PI均同意承接 → 申办方及项目组准备立项资料(清单见附件) → CRA在CTMS系统中申请立项 → 机构办形式审查 → 递交纸质版立项资料 → 研究者在OA钉钉上申请临床试验立项审批 → 立项完成
注:立项资料行审通过后,可同步发起伦理审查申请和合同初稿提交
一、项目承接意向洽谈
申办方/CRO将项目基本情况及试验方案摘要发至机构办对应邮箱,机构办和PI评估项目情况初步确定承接意向后回复邮件。
机构办邮箱:
药物临床试验:LHLYWGCP@163.com
医疗器械临床试验:LHLQXGCP@163.com
机构办咨询电话:0574-87018595
二、立项审查
1、申办方/CRO根据立项资料清单准备资料,完成申办方盖章、PI签字后,将立项资料扫描为PDF格式。
2、申办方/CRO登陆我院临床试验管理系统(CTMS),完成用户注册。
3、待机构办受理通过后,申办方/CRO登录系统,根据提示填写和上传立项资料扫描件。
4、系统行审通过后,纸质版立项资料递交机构办审核,审核完成后由研究科室保存。
临床试验管理和伦理审查系统(CTMS)网址:http://36.134.55.22:8001/
三、OA钉钉立项审批
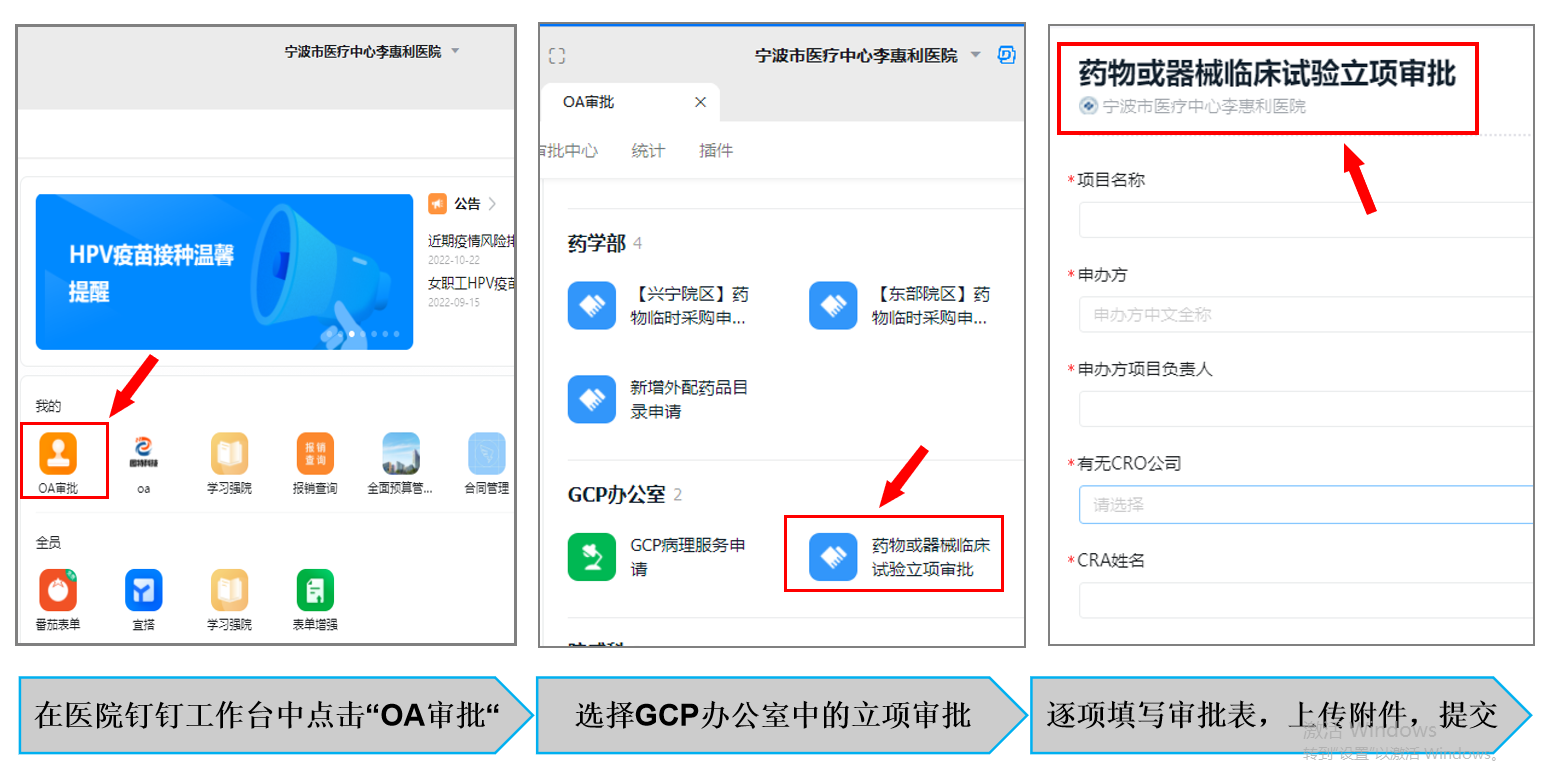
此步骤由科室研究者在医院钉钉上申请
四、立项资料装订说明
(1)PDF版立项资料审核通过后,递交一份纸质版立项文件至机构办公室审核后,有研究科室保存;
(2)装订顺序:按照临床试验申请表中“立项资料列表”的目录顺序和序号叠放;
(3)装订要求:
①每个材料之间请用隔页纸(带数字)隔开

②左侧打孔穿订整齐,放入档案盒内递交。



③档案盒的封面和侧面请按照“立项资料封面格式”的要求制作。
机构办工作时间:工作日8:00-11:30,13:30-17:00
附件: